Kasusrapport

Intrapulmonell perkussiv ventilasjon som ledd i tidlig rehabilitering av en COVID-19 pasient i sykehus.
Kasusrapport
Ina Christine Rasmussen, fysioterapeut, Fysioterapiavdelinga, Ortopedisk klinikk, Haukeland universitetssjukehus. Ina.christine.rasmussen@helse-bergen.no.
Ingunn Mjøs, spesialfysioterapeut, MSc, Fysioterapiavdelinga, Ortopedisk klinikk, Haukeland universitetssjukehus. ingunn.mjos@helse-bergen.no.
Aarid Liland Olsen, spesialfysioterapeut, PhD., Fysioterapiavdelinga, Ortopedisk klinikk, Haukeland universitetssjukehus.
Tiina Maarit Andersen, spesialfysioterapeut, PhD., postdoktor ved Nasjonal kompetansesetjeneste for hjemmerespiratorbehandling, Lungeavdelinga, og ved Fysioterapiavdelinga, Ortopedisk klinikk, Haukeland universitetssjukehus. Førsteamanuensis ved Institutt for helse og funksjon, Høgskulen på Vestlandet.
Kasusrapporter vurderes av fagredaktør. Ingen interessekonflikter oppgitt. Pasient har signert skriftlig informert samtykke, og med dette samtykket til denne publiseringen.
Sammendrag
COVID-19 er en sykdom som i hovedsak begrenser gassutvekslingen i lungene. Dette påvirker rehabilitering og evne til å trene. I denne kasusrapporten beskrives et utfordrende behandlingsforløp hos en eldre multimorbid mann med COVID-19 og gevinster av intrapulmonell perkussiv ventilasjon (IPV) som fysioterapeutisk tiltak i rehabilitering.
Vi erfarte at behandling med IPV bidro til bedre gassutveksling og dermed bedre evne til trening og rehabilitering. Behandlingen med IPV opplevdes utfordrende for pasienten, og det var nødvendig med et kompromiss mellom de maskininnstillinger som vurderes som faglig hensiktsmessige, og de maskininnstillinger som pasienten tolererte. I dette tilfellet var det hensiktsmessig å tilpasse behandlingen gjennom lavere trykk, lave frekvenser og kortere behandlingsøkter. Utgangsstillinger ble til enhver tid valgt ut fra pasientens oksygenering og toleranse for behandling.
Kasusrapporten beskriver et eksempel på at IPV kan være et effektivt hjelpemiddel i tidlig rehabilitering etter COVID-19 i sykehus. Større studier og mer erfaring med ulike behandlingsinnstillinger er nødvendig for å kunne fremskaffe tydelige anbefalinger for praksis.
Nøkkelord: COVID-19, intrapulmonell perkussiv ventilasjon, rehabilitering.
Innledning
COVID-19 er betegnelsen for sykdommen som blir utløst av SARS-COv-2 viruset. Den angriper i hovedsak lungefunksjonen, og kan i verste fall føre til død (1). Hos pasienter som overlever et alvorlig forløp av COVID-19, blir det i økende grad rapportert om vedvarende dyspnø, hypoksi og redusert fysisk kapasitet, og det er observert redusert gassutveksling, restriktiv lungefysiologi og fibrotiske forandringer i lungevev. Den hyppigste fysiologiske begrensningen i etterkant av alvorlig COVID-19 er redusert gassutveksling, og dette har betydning for funksjonsnivå og rehabiliteringsbehov (2).
Lungefysioterapi og intrapulmonell perkussiv ventilasjon (IPV)
Lungefysioterapi inngår som en viktig del av behandlingen når pasienter blir lagt inn på sykehus med pusteproblemer. Lungefysioterapi har som mål å forebygge eller behandle lungekomplikasjoner ved å øke slimmobiliseringen, øke gassutvekslingen, samt øke eller beholde lungevolumet (3). Blant mange mulige hjelpemidler vurderer fysioterapeuten hvorvidt der er behov for behandling med intrapulmonell perkussiv ventilasjon (IPV). IPV brukes for å mobilisere slim, reversere eller behandle atelektaser, og for å øke gassutvekslingen (3, 4). IPV påfører luftveiene intermitterende, dynamiske (perkussive) og positive trykk, på toppen av pasientens spontane respirasjon (3). Dette tilfører asymmetriske mekaniske bølger som endrer slimets viskoleastisitet og driver det fremover mot de proksimale delene av luftveiene med økt flowbias (ekspiratorisk flow>inspiratorisk flow) (3). Det positive trykket gjenvinner eller vedlikeholder lungevolumet, og øker den alveolære ventilasjonen (3). Perkussiv ventilasjon øker gassutvekslingen i lungene (5). IPV kan også intermitterende ventilere pasienter som ikke puster selv. Behandlingen kan utføres med bruk av munnstykke eller maske, og kan også tilkobles endotrakeal tube eller trakeostomi. IPV kombineres vanligvis med inhalasjonsbehandling, samt med hensiktsmessig posisjonering som begunstiger ventilasjons- og perfusjonforholdene i lungene (4).
Ved Haukeland universitetssjukehus (HUS) har IPV vært i bruk siden 2002, i samarbeid med Nasjonal kompetansetjeneste for hjemmerespiratorbehandling. Per dags dato har HUS to IPV-maskiner tilgjengelig, og ca. ti fysioterapeuter har kompetanse til å starte opp, evaluere og justere IPV-behandling. Alle fysioterapeuter i kvelds- og helgevaktordningen kan imidlertid utføre ferdig innstilt behandling med IPV. Vår erfaring er at IPV er et effektivt virkemiddel for en lettere og kortere avvenning fra respirator, noe som er avgjørende for etterfølgende rehabilitering og utskrivelse fra sykehus. IPV har vist seg å være en gjennomførbar og trygg behandlingsmetode for spontant pustende ikke-intuberte intensivpasienter (3). Flere studier beskriver gode resultater av IPV ved ulike lungelidelser hos barn og voksne, blant annet ved acute respiratory distress syndrome (ARDS) (4, 6). Det finnes foreløpig lite forskningsbasert kunnskap om IPV ved COVID-19. Man er i gang med å høste erfaringer, og en kasusrapport av Marchenko et al. (2020) beskriver tre pasienter med alvorlig COVID-19 lungebetennelse som fikk bedre lungefunksjon etter behandling med IPV (7). IPV er et lungefysioterapitiltak som igangsettes på bakgrunn av kliniske funn, snarere enn pasientens diagnose. Hos enkelte pasienter med COVID-19, har vi observert kliniske problemstillinger der IPV kan være hensiktsmessig. Vi vil i denne artikkelen presentere den første pasienten med post-COVID-19 respirasjonssvikt ved HUS som fikk systematisk behandling med IPV i en tidlig rehabiliteringsfase.
Pasienten
En 79 år gammel mann ble i mars 2021 innlagt på HUS med respirasjonssvikt type 1 og akutt nyresvikt. Han hadde testet positivt for COVID-19 åtte dager tidligere, og var sannsynligvis blitt smittet 22 dager før innleggelse. Pasienten bodde alene hjemme, uten hjelp i hjemmet. Han var tidligere røyker og hadde en sykehistorie med operasjon for lårhalsbrudd i 2007, abdominalt aortaaneurisme, atrieflimmer og aortainsuffisiens. Han hadde vært innlagt med respirasjonssvikt i 2017, og det ble da konkludert med sannsynlig kronisk obstruktiv lungesykdom (KOLS) GOLD II. Lungefunksjonstester fra november 2019 viste forsert vitalkapasitet (FVC) på 3.671 l (91%), forsert ekspiratorisk volum etter ett sekund (FEV1) 2.27 l (70%), samt redusert oksygenratio og gassutvekslingskapasitet. Ved innleggelse i mars 2021 fremstod pasienten med alvorlig hypoksi; rundt 70% i perifer oksygenmetning (SpO2) med 10-15 liter oksygen (O2) på maske, cyanose perifert og sentralt, samt taledyspnø. I tillegg hadde han takykardi, hypotensjon, og han var betydelig dehydrert med prerenal nyresvikt. Blodgass med 15 liter O2 viste respirasjonssvikt type 1 med partialtrykk av oksygen i alveolene (PaO2) 5.20 kPa og av karbondioksid (PaCO2) 3.12 kPa.
Behandlingsforløp
Etter innkomst ble pasienten direkte overført til Intensivmedisinsk seksjon. Han mottok standard behandling ved HUS for COVID-19 med mulighet for intubasjon (8). Han fikk behandling med bifasisk ventilasjonsstøtte (BiPAP/V60), med fraksjon av inspirert oksygen (FiO2) 0.5, raskt økt til 0.8. Dette gav en stigning i SpO2 til 87-90%. Han pustet med høye tidalvolum > 1000 ml og var totalavhengig av BiPAP for å holde SpO2 over 90%. Det ble gitt high-flow oxygen therapy (HFOT) ved måltider. Røntgen viste mulige bilaterale fortetninger, mest uttalt høyre side, og bilaterale atelektaseforandringer.
Dag 1-11: Forløp Intensivmedisinsk seksjon
Fysioterapi startet på dag 2 av intensivoppholdet. Pasienten ble mobilisert både til stående og over i stol. Han fremstod som sterk i kroppen, kun begrenset av sin respirasjonssvikt. Pasienten fikk fysioterapi daglig med tiltak som var tilpasset hans behov og tilstand, blant annet øvelser, mobilisering og posisjonering. På dag 3 etter innleggelse ble det besluttet å avstå fra respiratorbehandling og hjerte- og lungeredning (HLR minus) i denne situasjonen. Behandlingstiltak som allerede var satt i gang, ble videreført. Pasienten utviklet økende respirasjonssvikt dag 4 av intensivoppholdet. Det ble startet opp inhalasjoner med hypertont saltvann, da pasienten hadde produktiv hoste med purulent slim. Pasienten var klar og orientert gjennom forløpet, med unntak av forbigående delir dag 5-7 av innleggelsen. Pasienten samarbeidet bra i behandlingen. Han var påfallende rolig og fattet med tanke på sin respiratoriske status.
Dag 11-37: Tidlig rehabilitering ved Respiratorisk Overvåkningsenhet (ROE)
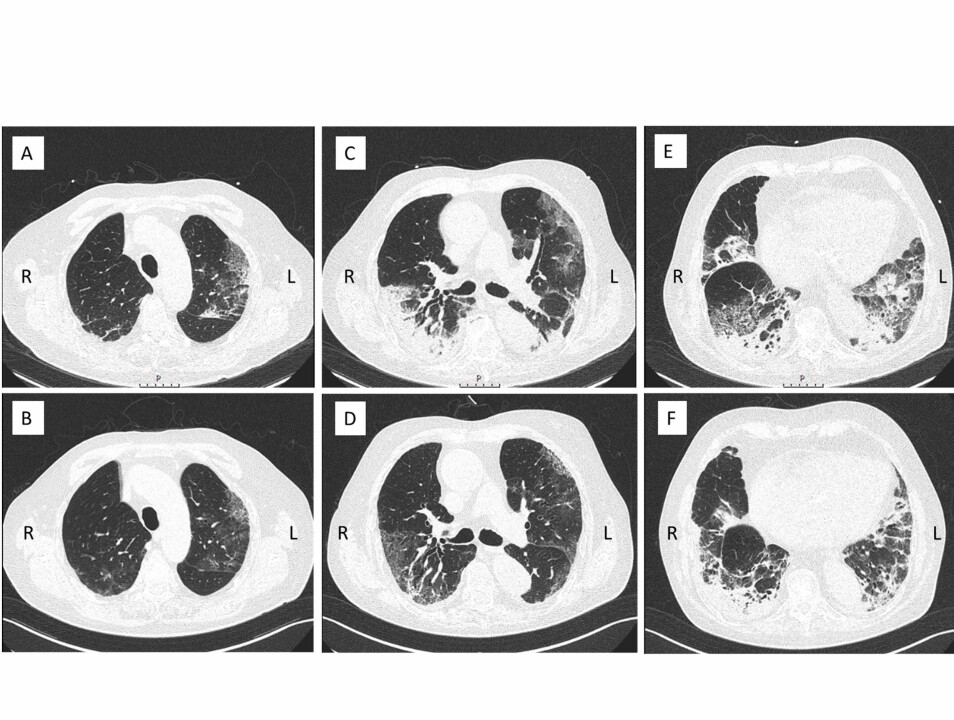
På dag 11 ble pasienten flyttet til intermediær avdeling, Respiratorisk Overvåkningsenhet (ROE), ved Lungeavdelingen. Pasienten hadde da diagnosene post-COVID-19 respirasjonssvikt type 1 og pneumoni. Computertomografi (CT) på dag 14 viste mattglassfortetninger, konsolidert perifert lungevev og traksjonsbronkiektasier (Figur 1). Han fremstod med grav hypoksi, med behov for 90-100% O2 på HFOT for å holde SpO2 rundt 85%. Pasienten hadde fremdeles produktiv hoste med purulent slim. Han ønsket i stadig mindre grad å bruke BiPAP, på tross av behov. Han fikk kontinuerlig HFOT, samt intermitterende BiPAP ca. 30 minutter fire ganger i døgnet. På dette tidspunktet flatet kurven for fremgang i rehabiliteringen ut. På grunn av avtagende bruk av BiPAP, vedvarende hypoksi, slimplager og fortetninger, og stillstand i pasientens generelle rehabilitering, ønsket behandlende lungelege at man startet behandling med IPV.
Behandling med IPV (IPV 2C, Percussionaire Intrapulmonary Percussive Ventilation Device (Percussionaire, Sandpoint, Sandpoint, ID, USA)) ble startet opp på dag 15. Pasienten fikk på dette tidspunktet HFOT kontinuerlig, og var ikke mobil utover at han forflyttet seg mellom seng og stol. Han kunne ikke være uten oksygen, da han i løpet av få sekunder fikk metningsfall ned mot 50-60% i SpO2. Målsettingen med IPV-behandlingen var å åpne fortetninger, og dermed øke gassutvekslingen og redusere hypoksi, for således å øke muligheten for rehabilitering og utskrivelse fra sykehus. Økt ventilasjonsstøtte med IPV oppnås ved å øke drivtrykket og redusere perkusjonsfrekvens, som reduserer pustearbeidet i større grad enn høye frekvenser (5). Anbefalt IPV drivtrykk for voksne i behandling med IPV 2C, ifølge produsenten, er 30-40 psi. Behandlingen ble gitt med et drivtrykk på 40 psi for å ventilere pasienten, og veksling mellom høye (>250 perkusjoner/min) og lave (<200 perkusjoner/min) frekvenser (Tabell 1). Hensikten var å løsne slimet med høye frekvenser, og deretter flytte slimet sentralt med de lave frekvensene. Innstilling av i:e-forhold (forholdet mellom inspiratorisk og ekspiratorisk tidsratio i en perkusjon) var satt på 1:2. Dette er en vanlig innstilling med IPV 2C for å unngå hyperinflasjon av lungene, samt øke ekspiratorisk flowbias (ekspiratorisk flow>inspiratorisk flow) som fasiliterer slimmobilisering og slimtransport (5).

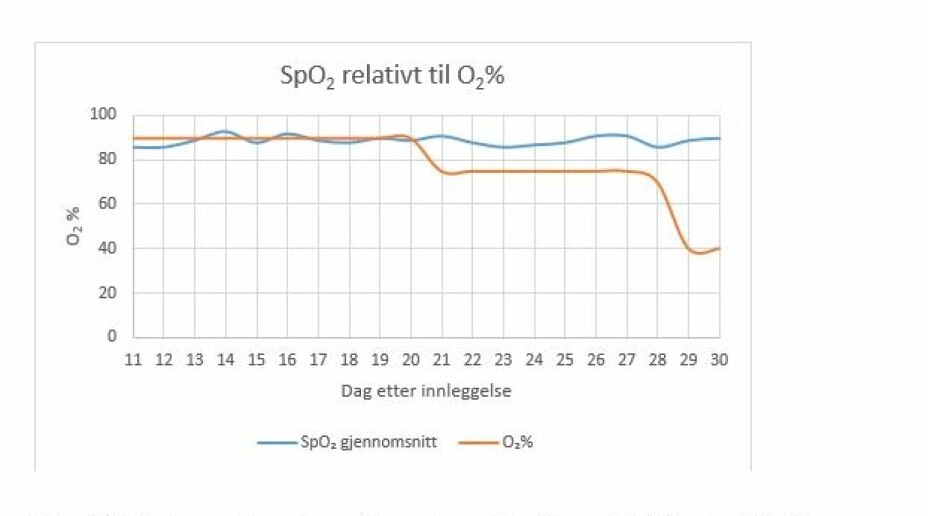
IPV-behandlingen ble gjennomført to ganger daglig i begge sideleier. Pasienten oksygenerte overraskende mye bedre i sideleie sammenlignet med i sittende eller i ryggleie. Han tolererte behandling i 5 min i hvert sideleie. IPV ble gitt med 100% O2, med mål om SpO2 > 85%. Pasienten opplevde behandlingen som respiratorisk krevende, og IPV ble seponert etter pasientens ønske, på dag 20 etter innleggelse. Fra dag 20 ble det akseptert en lavere nedre grense på 80% SpO2, og oksygenbehandlingen ble trappet ned fra 90% til 75% i O2 på HFOT. På denne tiden ble pasienten mobilisert til gange på korridor med 15-25 liter O2/min på maske, uten måling av SpO2. Rehabilitering ble vektlagt, og en eventuell kortvarig hypoksi ved aktivitet ble akseptert. Det viste seg at ventilasjonen var den begrensende faktoren for aktivitet og for å kunne oppnå fremgang i rehabilitering. Siden pasienten ikke ønsket overtrykksbehandling i form av BiPAP, og behandlingen med HFOT heller ikke bedret hans ventilasjon, ble IPV-behandlingen startet opp på nytt, med vekt på å tilpasse behandlingen til pasientens ønsker og toleranseevne (Tabell 1). Man valgte å redusere drivtrykket og frekvensene. Dette ville kunne gå på bekostning av slimdrenasje, men ville også kunne redusere pasientens eget pustearbeid og øke ventilasjonen (5). Pasienten tolererte behandlingen bedre etter disse endringene. Behandlingen ble fremdeles utført i begge sideleier, ca. 5 min i hvert sideleie.
Fra dag 28 ble oksygenbehandlingen trappet ned til 40% O2 uten at dette medførte endring i SpO2 (Figur 2). Fra dag 30 klarte pasienten seg med 4-5 liter O2 på nesekateter. Denne utviklingen tillot at pasienten kunne bevege seg fritt, og han klarte etter hvert å gå lengre avstander, ca. 100 meter, og gå i trapp. CT tatt dag 30 etter innleggelse støttet den kliniske fremgangen. Bildene viste tilbakegang av mattglassfortetninger og av konsoliderte fortetninger dorsalt bilateralt, sammenlignet med CT på dag 14. Bildene viste imidlertid også en volumreduksjon av høyre underlapp, og utvikling av fibrøse drag bilateralt (Figur 1).
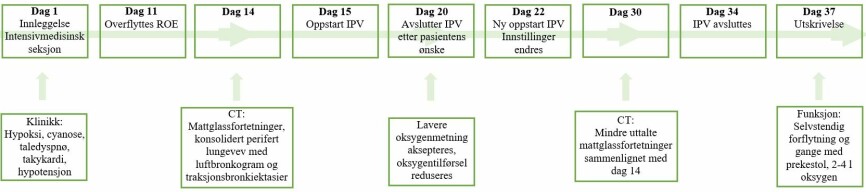
Pasienten var innlagt i 37 dager, hvorav de ni første var ved Intensivmedisinsk seksjon, og de resterende ved intermediær avdeling (ROE). Pasienten fikk behandling med IPV i til sammen 18 dager, med unntak av en seponering på to-tre dager (Figur 3). Pasienten hadde fremgang av rehabiliteringstiltak under sykehusoppholdet. Utfordringer med redusert ventilasjon ble behandlet med intermitterende IPV-behandling som et ledd i fysioterapibehandlingen. Ved utreise var han selvstendig i forflytning mellom seng og stol, og gikk selvstendig med prekestol. Han hadde fremdeles behov for oksygen, og ble utskrevet med hjemmeoksygen med 2-4 liter O2 på nesekateter. Det ble akseptert en SpO2 på > 80% ved utreise. Pasienten selv var ikke preget av hypoksi. Han ble utskrevet fra ROE til korttidsopphold i sykehjem.
Diskusjon
COVID-19 er en sykdom som i hovedsak begrenser gassutvekslingen i lungene. Dette påvirker rehabilitering og evne til å trene. Denne kasusrapporten beskriver en eldre multimorbid mann med COVID-19, med utfordringer og gevinster av IPV som fysioterapeutisk tiltak i tidlig rehabilitering.
Valg av behandlingstiltak
Ved HUS har behandlingstiltakene for pasienter med alvorlig sykdomsforløp etter COVID-19 utviklet seg betydelig siden starten av pandemien. Usikkerhet rundt sykdommen tidlig i pandemien gjorde at en del vanlige behandlingsmetoder ble vurdert som mindre aktuelle for disse pasientene. Blant annet ble bruken av IPV forbeholdt andre pasientgrupper på grunn av smittefaren ved å flytte maskinen mellom pasientene. Økende kunnskap om COVID-19, god tilgang på utstyr for smittevern, samt bedre avisoleringsrutiner, har imidlertid utvidet behandlingsmulighetene. Man har dermed i større grad kunnet tilby de mest hensiktsmessige lungefysioterapeutiske tiltak også til pasienter med COVID-19. I tilfellet som er beskrevet i denne artikkelen, ble IPV tatt i bruk både på grunnlag av pasientens behov, pasientens plassering i sykehuset, samt vår utvidete kunnskap om COVID-19 og dens følgetilstander. Siden pasienten ikke skulle tilbys respiratorbehandling, ble IPV et viktig virkemiddel for å forsøke å få pasienten gjennom forløpet. Frem til mars 2021 hadde vi ikke erfaring med systematisk IPV-behandling av pasienter med COVID-19 ved HUS, og situasjonen var ny og uoversiktlig for alle faggrupper. Frem til da hadde man ved Intensivmedisinsk seksjon gjort noen forsøk på å behandle COVID-19-pasienter ved hjelp av IPV, men det viste seg at disse pasientene var blitt henvist for sent i forløpet til å ha nytte av behandlingen.
Utfordrende behandling for pasienten
Flere tidligere studier har rapportert om betydelige sekveler etter alvorlig COVID-19, med blant annet mattglassfortetninger på CT og vedvarende hypoksi (1, 2). Slik var tilfellet også for pasienten som er presentert i denne artikkelen. Han avviste overtrykksbehandling med BIPAP, men var motivert for tiltak som kunne øke hans lungefunksjon og gi ham mulighet til å trene. I utgangspunktet var han positiv til IPV-behandling, men etter få dager ønsket han å avslutte behandlingen med IPV, fordi den var for krevende. I ettertid vurderte man at årsakene til dette blant annet kunne være organisatoriske. Behandlingen ble nemlig startet opp rett før påske, noe som innebar at pasienten de første dagene ble behandlet av fysioterapeuter i vaktordning. Disse kunne ikke forventes å ha tilstrekkelig erfaring og kompetanse til å evaluere pasientens tilbakemeldinger og justere apparatet tilsvarende. Etter påske var det i større grad kontinuitet i personell og behandling, og det ble gjort tilpasninger basert på pasientens respons, og på faglig erfaring. Dette førte til en mer optimal behandlingsstrategi som fungerte bedre for pasienten.
Innstilling av maskinen
Avhengig av ønsket behandlingseffekt blir det gjort innstillinger for tre ulike parametre på IPV-maskinen. Det dreier seg om frekvens (fra 60-400 perkusjoner/min), forhold mellom inspirasjons- og ekspirasjonstidsratio (i:e-forhold) og trykk. Innstillingene på disse parametrene påvirker flow, positivt ende-ekspiratorisk trykk (PEEP) og perkusjon. Det er enighet om at IPV kan være effektiv for slimmobilisering, ventilering og rekruttering av lungevev, men vi vet foreløpig lite om hvilke innstillinger som er de optimale for de respektive effekter (5). I praksis betyr dette at innstillinger gjerne må endres med hensyn til evalueringer som gjøres underveis i behandlingsforløpet. Ved HUS er det vanlig å gjennomføre IPV-behandling med en varighet på totalt 15-20 min aktiv behandlingstid. For pasienten som er beskrevet i denne artikkelen var behandlingstiden relativt kort, ca. 10 min per behandling. Dette viste seg imidlertid å være tilstrekkelig for å oppnå effekt. Pasienten fikk evakuert slim, og han hadde raskt avtakende slimstagnasjon. CT bilder tatt på dag 14 og dag 30 av sykehusoppholdet, viste tilbakegang av fortetninger i lungene, men ikke tilbakegang av konsolidert lungevev. Målsettingen videre ble dermed å rekruttere lungevolum, noe som kunne oppnås med lave frekvenser (5), noe pasienten også foretrakk. Han tolererte ikke trykk som vanligvis brukes, dette kan trolig tilskrives stivhet i lungene som følge av COVID-19. En av fordelene med IPV er at man kan oppnå en skånsom rekruttering av alveoler med lave trykk, og vi erfarte at dette var effektivt for vår pasient.
IPV-behandlingen ble gitt med 100% O2 ved oppstart. Videre ble oksygentilførselen gradvis redusert ned mot 40%. Avtagende slimmengder og redusert oksygenbehov gav muligheter for mer effektiv rehabilitering, noe som fremskyndet tidspunktet for utskriving fra sykehus. Pasienten fikk ingen annen ventilasjonsstøttende behandling som kunne forklare den respiratoriske fremgangen. Tilsvarende gode resultater av IPV er også beskrevet i Marchenko et al. (7) sin kasusrapport, der IPV førte til reduksjon i lungelesjoner på CT og betydelig redusert oksygenbehov hos tre pasienter.
Konklusjon
Vi har i denne kasusrapporten beskrevet en pasient med respirasjonssvikt etter alvorlig COVID-19 sykdom. Han ble behandlet med IPV som et støttende tiltak i en rehabiliteringsprosess. Vi erfarte at behandling med IPV ga gode resultater og bidro til bedre gassutveksling og dermed til mer effektiv trening og rehabilitering.
Ut fra vår erfaring vil bruk av IPV kreve et kompromiss mellom de maskininnstillinger som vurderes som faglig hensiktsmessige, og de maskininnstillinger pasienten tolererer. Fysioterapeutens erfaring og kompetanse i å evaluere og justere IPV-behandlingen kan være avgjørende for en optimal tilpasning. Denne kasuistikken viser et eksempel på at IPV kan være et effektivt hjelpemiddel i tidlig rehabilitering etter COVID-19 i sykehus. Større studier og mer erfaring med ulike behandlingsinnstillinger er nødvendig for å kunne fremskaffe tydelige anbefalinger for praksis.
Referanser
1. Lutchmansingh DD, Knauert MP, Antin-Ozerkis DE, Chupp G, Cohn L, Dela Cruz CS, et al. A Clinic Blueprint for Post-Coronavirus Disease 2019 RECOVERY: Learning From the Past, Looking to the Future. CHEST. 2021;159(3):949-58. https://doi.org/10.1016/j.chest.2020.10.067
2. Nalbandian A, Sehgal K, Gupta A, Madhavan MV, McGroder C, Stevens JS, et al. Post-acute COVID-19 syndrome. Nat Med. 2021;27(4):601-15. https://doi.org/10.1038/s41591-021-01283-z
3. Hassan A, Milross M, Lai W, Shetty D, Alison J, Huang S. Feasibility and safety of intrapulmonary percussive ventilation in spontaneously breathing, non-ventilated patients in critical care: A retrospective pilot study. J Intensive Care Soc. 2021;22(2):111-9. https://doi.org/10.1177/1751143720909704
4. Lucangelo U, Fontanesi L, Antonaglia V, Pellis T, Berlot G, Liguori G, et al. High frequency percussive ventilation (HFPV). Principles and technique. Minerva Anestesiol. 2003;69(11):841-8, 8-51.
5. Toussaint M, Guillet MC, Paternotte S, Soudon P, Haan J. Intrapulmonary effects of setting parameters in portable intrapulmonary percussive ventilation devices. Respir Care. 2012;57(5):735-42. https://doi.org/10.4187/respcare.01441
6. Lucangelo U, Zin WA, Fontanesi L, Antonaglia V, Peratoner A, Ferluga M, et al. Early short-term application of high-frequency percussive ventilation improves gas exchange in hypoxemic patients. Respiration. 2012;84(5):369-76. https://doi.org/10.1159/000334403
7. Marchenko SP, Scarlatescu E, Vogt PR, Naumov A, Bognenko S. Intermittent High-Frequency Percussive Ventilation Therapy in 3 Patients with Severe COVID-19 Pneumonia. Am J Case Rep. 2021;22:e928421. https://doi.org/10.12659/ajcr.928421
8. Haukeland universitetssykehus: Kvåle R, m.fl. Metodebok i intensivmedisin: Covid-19 intensivbehandling (2020). Tilgjengelig fra helsebiblioteket.no. https://www.prosedyrer.no/index.php?action=showtopic&topic=6MtnME9C&book_request=intensivhus&highlight=true (avlest 6.9.2021).

























