Hvem kan du egentlig stole på? Utfordringer med kunnskapsinnhenting og evidensbasert praksis
Bokkapittel. Kun på nett.
Ingrid Eitzen, fysioterapeut, ph.d. Forskningsleder SINTEF Digital Smarte sensorsystemer. Ingrid.eitzen@sintef.no.
Denne artikkelen er et revidert utdrag fra den kommende bokutgivelsen Idrettsfysioterapeuten: Breddeidrett. Toppidrett. Aktivitetsmedisin (Cappelen Damm Akademisk), som er planlagt utgitt i mars 2020. Utdraget publiseres etter avtale med forlag og forfatter.
Begrepet evidensbasert medisin oppstod tidlig på 90-tallet (1). I fysioterapeutisk praksis brukes dette begrepet ofte som synonym til å jobbe kunnskapsbasert. Det er lett å si – og burde være lett å være enig i – at vår praksis som idrettsfysioterapeuter skal være kunnskapsbasert. Men hva betyr det i praksis? Betyr det at man kun skal benytte behandlingsmetoder eller kliniske protokoller som er vist å ha en statistisk signifikant effekt? Hvilket design og hvilken kvalitet hadde i så fall studiene som har påvist denne effekten? Er utvalget i studiene representativt for den pasienten du har foran deg? Vil det at noe er statistisk signifikant automatisk bety at det har stor klinisk betydning? Og, er du sikker på at du har lest alle de nyeste og mest relevante studiene på feltet – eller at de kommer til samme konklusjon?
Å orientere seg i mengden av tilgjengelig informasjon i fagartikler og bøker, på faglige diskusjonsforum, på internett og ikke minst i sosiale medier er en betydelig utfordring. Hvor skal du begynne? Hva må du vite for å kunne vurdere påliteligheten i det du leser? Og, kan du stole på at et forskningsresultat er sant, så lenge det er publisert i et tidsskrift? Dette er spørsmål du forhåpentligvis vil være bedre rustet til å ta stilling til etter å ha lest denne artikkelen.
Hvordan koble evidens og praksis?
God forskning bør alltid starte med at man definerer et forskningsspørsmål, som er fundert i det vi allerede vet om et tema. Med andre ord: Hva har andre forskere allerede funnet ut – og hvor er det fortsatt kunnskapshull? Dette hullet skal man så prøve å tette, ved å stille et presist forskningsspørsmål. Dette høres jo enkelt ut. I realiteten er det imidlertid ganske komplisert å komme frem til klare, evidensbaserte løsninger på kliniske spørsmål.
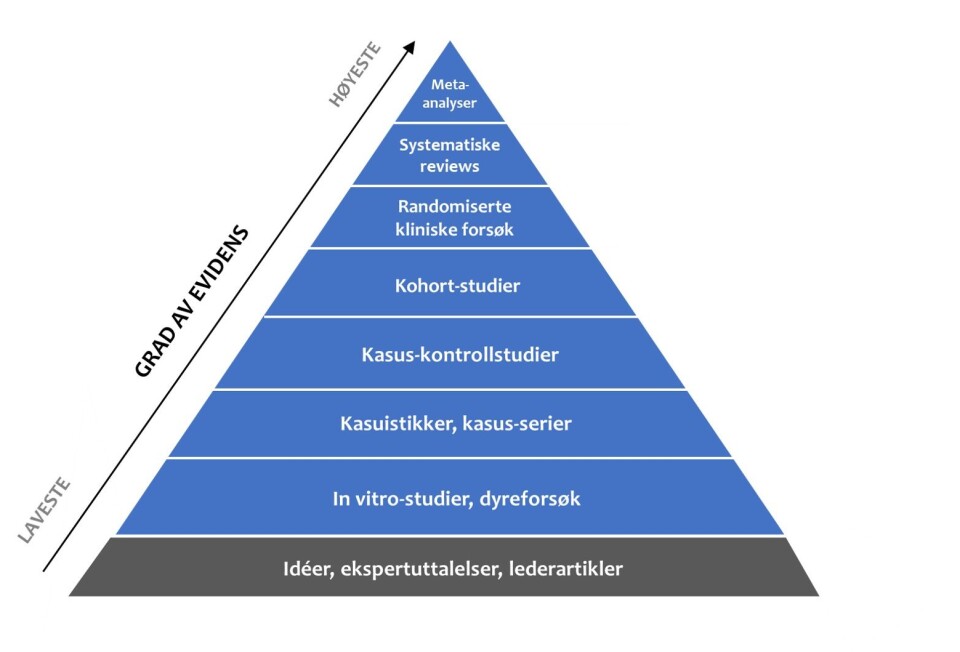
For å eksemplifisere dette kan vi se litt nærmere på forskningen rundt behandling av korsbåndsskader. Lenge var det etablert praksis at alle som røk fremre korsbånd (ACL) gjennomgikk rekonstruktiv kirurgi. Siden operasjon var vanlig praksis, visste man lite om hvordan det egentlig gikk med de som ikke ble operert. Måtte de slutte med idrett? Begynne med en annen form for aktivitet? Hvor god funksjon kunne man egentlig få uten operasjon? Lenge var det tilsynelatende enighet om at en viktig grunn til at å gjennomgå ACL-rekonstruksjon var å forebygge artrose. Men, dette hadde man jo egentlig ikke noen gode data på, siden ingen hadde sammenlignet større grupper av individer som var operert med de som ikke var operert. Her hadde man med andre ord flere kunnskapshull. To spørsmål har derfor vært gjenstand for betydelig oppmerksomhet de siste tiårene: 1. Hva gir best resultat etter en ACL-ruptur – operativ eller ikke-operativ behandling. 2. Vil det å rekonstruere korsbåndet forebygge utvikling av artrose? Mange studier har forsøkt å svare på disse to spørsmålene – flere også med et såkalt randomisert klinisk kontrollert (RCT) design (2), som er det høyeste nivået for kliniske studier jamfør evidenspyramiden (figur 1). Så har vi fått noen klare svar?
Figur 1: Evidenspyramiden: Nivåer av evidens fra ulike typer studierSammenfattet viser forskningen nå at ganske mange kan klare seg helt fint uten rekonstruert ACL, i hvert fall i det daglige og i aktiviteter som ikke utsetter kneet for vridning (3). Noen kan også fortsette med idretten sin uten problemer. Andre, derimot, opplever sviktepisoder og pådrar seg ytterligere skade på menisk eller brusk i samme kne (4–6). Det er med andre ord ganske store individuelle forskjeller. Selv om det finnes flere studier som har vist at man gjennom funksjonstester og selvrapporterte spørreskjemaer kan skille mellom de som har god dynamisk stabilitet uten ACL (såkalte copers) og de som ikke har det (non-copers),(7–9) gir ikke dette entydige svar på hvor godt de vil fungere – det er blant annet avhengig av hva slags aktivitet de driver med og hvor gamle de er. Rekonstruksjon løser imidlertid heller ikke alle problemer. Blant de som gjennomgår rekonstruksjon vil noen rerupturere graftet eller få en ruptur på motsatt side (10–12). Forskningen har også vist at mange reduserer aktivitetsnivået sitt, uansett om de opererer eller ikke (13,14). Det er altså mange som ikke kan gå tilbake til idretten sin, uansett valg av behandling.
Hva med artroseutvikling? En systematisk oversiktsartikkel fra 2019 viser at vi ikke kan si at det er forskjell i artroseforekomst mellom de som er operert og de som ikke er operert, men tallene i de inkluderte studiene i den systematiske oversikten varierte veldig – fra 8 til 80 % (15). Vi kan altså fortsatt ikke gi et klart svar på dette spørsmålet. Er det sånn at de som slutter med krevende såkalte vridningsidretter på nivå 1 (håndball, fotball, innebandy, basket og krevende skikjøring) kommer bedre ut av det med tanke på artrose? Det kan vi heller ikke si med sikkerhet, basert på forskning. En studie med langtidsoppfølging av rekonstruerte pasienter (16) viste at de som returnerte til vridningsidrett innen to år etter operasjonen hadde mindre artrose, var yngre, hadde kortere tid mellom skade og operasjon og hadde bedre knefunksjon enn de som ikke gjorde det. Samtidig vet vi at episoder med svikt eller vridning av kneet, dersom de forårsaker skade på menisk eller brusk, øker risikoen for artrose – og sjansen for å oppleve en sviktepisode er definitivt større dersom man driver med denne type aktiviteter.
Så - hvis vi skal jobbe kunnskapsbasert – hva skal vi si til pasientene? Bør vi anbefale dem å operere eller ikke? Det kommer helt an på hva de ønsker å drive med av aktivitet og hvor god funksjon de klarer å oppnå gjennom rehabilitering og trening. Bør vi anbefale dem å slutte med krevende vridningsidrett? Kanskje, hvis vi legger vekt på at de bør unngå risikoen for sviktepisoder, reskader og nye skader. Men alle som har prøvd vet at det ikke er så lett å be noen om å slutte med idretten sin. Og igjen – vi har ikke en entydig anbefaling til alle, basert på tilgjengelig vitenskapelig evidens.
Oppsummert vet vi altså fortsatt ikke hvem som kan klare seg uten operasjon, hvem som kan fortsette med idrett uten problemer, og hvem som får artrose om ti år. Dermed kan vi, til tross for all evidens som har blitt fremskaffet, heller ikke gi så klare svar som vi skulle ønske på det pasientene oftest spør om: Kan jeg fortsette med håndball? Må jeg operere for å fortsatt kunne kjøre freeski med gutta? Kan jeg få problemer med kneet om ti år hvis jeg ikke slutter med bedriftsfotballen på tirsdager?
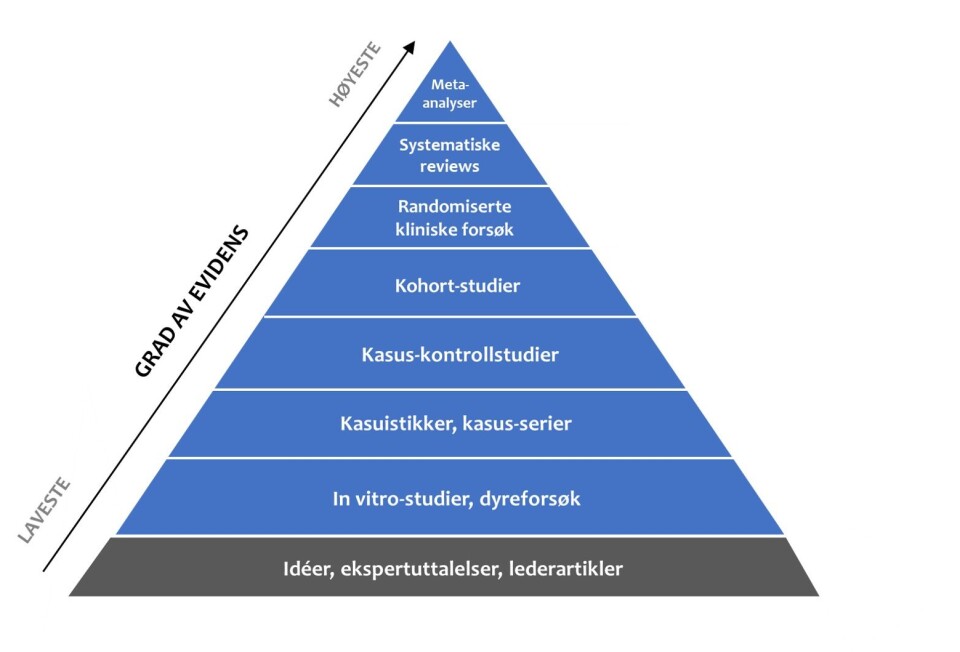
Dette virket kanskje forvirrende. Hvorfor kan vi ikke gi tydeligere svar på dette, når det er gjort masse forskning? Her er vi ved noe av det som er kjernen ved forståelsen av å jobbe kunnskapsbasert: Vitenskapelig evidens alene kan aldri gi deg som fysioterapeut svaret du søker for hva som er best for hver enkelt pasient. For å kunne gi best mulige råd til den enkelte og ta de riktige valgene med tanke på behandling og oppfølging må du legge til to ting: Din egen – og andres – praksisbaserte erfaring, og pasientens preferanser (17). Modellen for kunnskapsbasert praksis har derfor tre grener (figur 2):
Figur 2: Kunnskapsbasert praksis (Figur hentet fra www.kunnskapsbasertpraksis.no og gjengis med tillatelse)
En viktig grunn til at vitenskapelig evidens alene ikke kan gi deg noen fasit, er at alle kliniske studier kun representerer et utvalg av pasienter. Disse er rekruttert inn i studiene etter gitte inklusjons- og eksklusjonskriterier, for å gjøre gruppene mest mulig like og dermed sammenlignbare (er det stor forskjell på gruppene i utgangspunktet vil det jo ikke gi noen mening å sammenligne dem). Derfor vil du heller ikke alltid kunne finne vitenskapelige studier hvor forsøkspersonene ligner på den pasienten du har foran deg. De kan være eldre, yngre, mer eller mindre aktive, bedre eller dårligere trent i utgangspunktet, på et annet nivå, mer eller mindre motivert for å trene. Det som fungerte for flertallet i studien fungerer ikke nødvendigvis like godt for din pasient.
Det er også svært viktig å huske at studier som regel konkluderer på bakgrunn av analyser på gruppenivå. Innad i en gruppe vil det imidlertid alltid være variasjon. La oss si at en studie har sett på om to ulike treningsprogram gjennomført i en 12 ukers periode gir ulik fremgang i 1 RM i leg extension hos pasienter med patellartendinopati. Studien har et randomisert design og de to gruppene skulle i utgangspunktet være ganske så like på alle andre faktorer enn treningsprogrammene. Studien viser at de som var i den ene gruppen i gjennomsnitt økte muskelstyrken med 7,2%, mens den andre gruppen økte hele 17,4%. Resultatet er statistisk signifikant. Men ser du nærmere på resultatene (og det bør du alltid gjøre!), så ser du at variasjonen i fremgang er betydelig innad i begge gruppene, og størst i gruppen som hadde mest fremgang. Her varierte faktisk fremgangen fra ingenting til 29,3 %, mens det i den andre gruppen var mindre sprik; 2,5% til 11,7%. En annen måte å lese disse resultatene på er da at i den gruppen med gjennomsnittlig størst fremgang var det noen som forbedret seg veldig mye, mens andre faktisk ikke forbedret seg noe som helst. I gruppen med minst fremgang på gruppenivå var det ingen som forbedret seg så dramatisk – men de aller fleste forbedret seg noe. De som responderer veldig bra på en intervensjon kaller vi gjerne responders (18). Men hvordan kan du på forhånd si om din pasient vil være en responder eller ikke? Det er i mange tilfeller dessverre nesten umulig. At noe fungerer veldig bra for noen, men ikke for andre, er noe vi alle kjenner igjen fra praksis. Mange ting vil spille inn, ikke bare pasientens funksjon og fysiske symptomer, men også psykologiske faktorer som motivasjon, tiltro til egen mestring og eventuell fear avoidance (19). Da må vi huske de to andre sirklene i kunnskapsbasert praksis, og ikke legge vekt kun på den vitenskapelige.
Skal du i dette fiktive eksempelet ikke bry deg om studien du har lest, da? Jo selvfølgelig! God kunnskapsbasert praksis ville her være å prøve ut prinsippene i det programmet som hadde så god effekt. Så må du alltid vurdere en masse tegn underveis: Klarer min pasient å utføre disse øvelsene, kan han følge opp programmet slik det er beskrevet, får han økt hevelse eller smerter, og ikke minst – har han fremgang? Studien rapporterte forøvrig ingenting om hevelse eller smerte i de to gruppene, det skulle du gjerne likt å vite noe om. Da må du bruke din kliniske erfaring og sammen med pasienten finne ut hvordan dere kan komme videre. Om du ikke ser fremgang eller din pasient opplever så mye smerte at han ikke kan utføre programmet, hjelper det ikke at det hadde effekt for en del av de som deltok i studien.
Kan man stole på at forskningen er troverdig?
Forskning blir sett på som svært troverdig, noe som er sant, noe vi kan stole på. Dessverre er det ikke alltid slik. Innen medisin og helsefag har det vært flere saker der det har blitt avdekket alvorlig forskningsjuks. Juks i forskningen omfatter tilfeller der en forsker eller en forskningsgruppe bevisst har falsifisert, fabrikkert eller duplisert data (20). Hensikten er i de fleste tilfellene å få publisert disse funnene i et høyt rangert tidsskrift; for å oppnå den anerkjennelse og potensielt karrierefremmende oppmerksomheten dette medfører.
Forskningsjuks er alvorlig. At man får oppmerksomhet og ære man ikke fortjener er ille nok, men den mest alvorlige konsekvensen er at resultatene blir anvendt i klinisk praksis. Det er jo derfor vi har vitenskapelige publikasjoner i utgangspunktet – for at vi skal inkludere vitenskapelig evidens i vår pasientbehandling. Historien har flere stygge eksempler på at fabrikkerte eller falsifiserte forskningsresultater har gjort skade i klinisk praksis. Et tilfelle er den amerikanske anestesilegen Scott Reuben, som var en svært anerkjent forsker innen postoperativ smertelindring. Hans forskning, som senere ble vist å være systematisk juks, har ført til at millioner av pasienter har fått for lite smertestillende medisin før og etter ortopediske operasjoner[1]. I Norge er den såkalte Sudbø-saken den mest kjente. Legen og forskeren Jon Sudbø fikk publisert revolusjonerende resultater om virkningen av NSAIDS på kreft i munnhulen i det svært anerkjente tidsskriftet Lancet. Sudbøs funn var så oppsiktsvekkende at klinisk praksis ble endret nærmest over natten, og Sudbø selv fikk internasjonal stjernestatus. I ettertid viste det seg at resultatene var fabrikkert.
Det er vanskelig å oppdage forskningsjuks. Dersom en forsker har falsifisert eller fabrikkert data, er det tilnærmet umulig å oppdage for fagfeller eller redaktører i tidsskrift. De fleste sakene blir derfor avslørt gjennom varsling fra kolleger i vedkommende sitt forskningsmiljø eller andre miljøer innen samme fagfelt, som stusser over resultatene. En mer åpen tilgang til og deling av data vil forhåpentligvis kunne heve terskelen for at noen forskere tør å falle for fristelsen til å jukse for egen vinnings skyld, på pasientenes bekostning.
Heldigvis er de aller fleste forskere redelige mennesker og fagpersoner. Bevisst forskningsjuks forekommer relativt sjelden. Imidlertid foregår det en del aktivitet som ligger i gråsonen til uredelighet i forskning. Dette er altså ikke overlagt juks, men det er likevel en praksis som bryter med god forskningsetikk (21). Eksempler på uredelig forskningspraksis er:
- å utelate negative eller uønskede resultater fra en artikkel, og kun inkludere det du ønsket å finne
- å la være å publisere resultater i det hele tatt, dersom du ikke finner det du ønsker
- å prøve mange ulike former for statistiske analyser helt til du finner en metode som gir deg de resultatene du ønsker (å gå på fisketur)
- å inkludere andre forskere på forfatterlisten som ikke har bidratt (vennetjenester)
- å utelate forskere som burde ha vært på forfatterlisten (går ofte utover de som er lavest på den akademiske rangstigen)
- å dele opp resultatene fra en studie i mange små publikasjoner i hensikt å få ut flest mulig publikasjoner og tilhørende publikasjonspoeng (salami-publisering)
- å ikke opplyse om relevante interessekonflikter (mot produsenter, miljøer eller tilknytning til andre som kan ha fordel av resultatene)
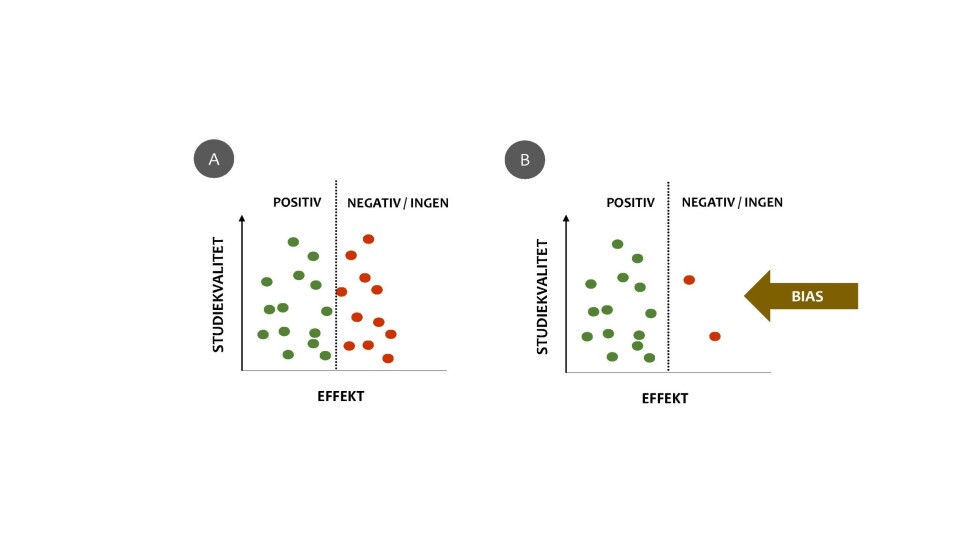
Dette forekommer dessverre i forskningsmiljøer både her hjemme og internasjonalt. Å varsle om dette er vanskelig. Det kan jo også i noen tilfeller være at denne type praksis ikke gjøres bevisst, men skyldes en ukultur som har fått leve over tid, hvor de involverte ikke tenker på det som uredelighet. Uansett har denne type praksis også uheldige konsekvenser, hvorav den kanskje viktigste er utelatelsen av negative funn (at du ikke fant det du ønsket eller at du ikke fant noen positiv endring). Å utelate negative resultater gir en bias i den samlede litteraturen på et felt, som kan få konsekvenser for klinisk behandling (22). Igjen – hvis vi skal jobbe evidensbasert, så må vi ha tilgang til all vitenskapelig evidens, ikke bare den som viser resultater i én (som oftest positiv) retning. Det kanskje mest åpenbare eksemplet man kan bruke her er forskning innen farmakologi. Hvis man kun publiserer resultater som viser positiv effekt av et medikament, vil det innebære at resultater som viser liten eller ingen effekt aldri blir tilgjengelige. Dette kan føre til en tro på at noen medikamenter har bedre effekt enn hva som reelt er tilfelle og et uhensiktsmessig forbruk for mange pasienter. Det samme prinsippet gjelder for studier på trening og rehabilitering. Dersom vi skal få et troverdig evidensgrunnlag fra systematiske oversiktsartikler og metaanalyser, som er helt på toppen av evidenspyramiden, må de negative resultatene også publiseres (figur 3).
Figur 3: Bias i metaanalyser ved utelatelse av negative resultaterHver prikk illustrerer en studie. Eksempel A viser en situasjon der både studier med positive (grønne prikker) og negative/ingen (røde prikker) resultater blir publisert. Eksempel B viser situasjonen slik den er mer reelt: Langt færre studier med negativ/ingen effekt publiseres[2].
Helt til slutt er det også slik at selv om forskningen er redelig, finnes det mye dårlig forskning. Ærlige og samvittighetsfulle forskere kan gjøre studier av dårlig kvalitet, med få inkluderte deltakere, unøyaktighet i metode eller gjennomføring, lite presis resultatpresentasjon og med feil bruk av statistikk i analysene. Særlig med tanke på sistnevnte har vi et problem. Det finnes en rekke studier som har påpekt utbredte statistiske feil i publisert forskning, også i høyt anerkjente tidsskrift[3]. Konklusjonen av slike studier er lite verdt, men det er vanskelig – for ikke si umulig – å avsløre dårlige studier hvis du bare leser konklusjonen, skummer gjennom sammendraget eller stoler på noen som entusiastisk har delt noen utvalgte funn på Twitter. Gjør det derfor til en vane å alltid se nøye på metode og resultatpresentasjon i alle artikler du leser. Dette vil gi deg et godt grunnlag for å vurdere om resultatene er av verdi. Synes du dette er vanskelig så gjelder det samme her som i klinikken – spør en kollega som har mer erfaring på området enn deg. Å ta opp artikler til diskusjon og kritisk se på metode, gjennomføring og resultatpresentasjon på fagmøter er også en veldig god læring for alle som jobber ute i klinikken.
Nettsider og sosiale medier som kunnskapskilde
Den siste delen av denne artikkelen omhandler den digitale kunnskapen du blir eksponert for hver eneste dag hele uken igjennom. Du kan finne nærmest uendelige kilder til kunnskap på internett gjennom ulike faglige diskusjonsforum, hjemmesider, blogger, YouTube-kanaler og ikke minst i sosiale medier. Og det er jo bra! Det er mye enklere å ta frem telefonen på t-banen på vei hjem fra jobb og sveipe innom noen blogger eller en YouTube-snutt som viser effektive øvelser for pasienter med skuldersmerter enn å lese en hel artikkel. Kanskje er det noen produsenter som legger ut noe nytt du synes ser spennende ut og som du tenker vil være et godt hjelpemiddel på din klinikk. Det ser i hvert fall overbevisende ut, de har en toppidrettsutøver som sier at han merker stor forskjell etter at han har fått behandling med dette produktet, og det vises til at det er forskningsbasert. Du følger kanskje også flere profilerte personer og miljøer på sosiale medier som har en stor følgerskare, sterke meninger og er utrolig flinke til å løfte frem eksempler du kan relatere deg til. Ofte har de lagt ved masse linker til forskning, så det virker overbevisende og du føler deg trygg på at de vet hva de snakker om. Så hva er problemet?
I seg selv trenger ikke denne måten å innhente informasjon på være noe problem, så lenge du alltid husker å legge på et filter av kildekritikk. Men utelater du dette filteret kan disse kildene fort bli en veldig lite egnet for en balansert kunnskapsbasert praksis. Vi er alle påvirket av såkalt confirmation bias (eller på norsk bekreftelsestendens). Dette begrepet henspiller på at vi alltid, helt ubevisst, umiddelbart tiltrekkes av ting som stemmer godt overens med det vi allerede kan noe om, tror på eller liker. Dette betyr at du vil lese mer av det som passer med det du allerede kjenner deg igjen i, følge de som mener det samme som deg og delta i diskusjoner der du og de andre som er enige med deg kan støtte hverandres argumenter. Det kan gi deg en følelse av å få bekreftet at det du holder på med er riktig og fornuftig. Og det kan det jo godt hende at det er! Som kilde til kunnskap vil det imidlertid være alt for snevert, dersom du ikke husker å minne deg selv på at det finnes andre som mener noe annet, har en annen erfaring, eller ville linket til helt andre artikler – med kanskje helt andre konklusjoner. Leser du forresten artiklene det linkes til i fulltekst, eller nøyer du deg med utdrag og fortolkninger gitt av personen du følger, og stoler på disse? Han eller hun er også preget av confirmation bias. Vet du om han eller hun har sett nøye på metodikk og kvalitet i studiene det refereres til?
Som i alle andre bransjer finnes det influencere også innen idrettsfysioterapien. Mange bidrar til fagutvikling, skaper nettverk, løfter frem gode diskusjoner og gjør miljøene mer åpne og tilgjengelige. Følg dem gjerne, men tør å være uenig, tør å stille spørsmål og vær kritisk til behandlingsmetoder, kurs og produkter som presenteres å kunne gi kjappe løsninger på noe forskningen ikke har klart å svare på i løpet av de siste tjue årene.
Referanser
1. Chang, S. & Lee, T. H. Beyond Evidence-Based Medicine. New England Journal of Medicine 379, 1983–1985 (2018).
2. Kabisch, M., Ruckes, C., Seibert-Grafe, M. & Blettne, M. Randomized Controlled Trials. Part 17 of a Series on Evaluation of Scientific Publications. Deutsches Ärzteblatt International 108, 663–668 (2011).
3. Konrads, C. et al. Long-term outcome of anterior cruciate ligament tear without reconstruction: a longitudinal prospective study. International Orthopaedics 40, 2325–2330 (2016).
4. Brambilla, L. et al. Prevalence of Associated Lesions in Anterior Cruciate Ligament Reconstruction. The American Journal of Sports Medicine 43, 2966–2973 (2015).
5. Mehl, J. et al. The ACL-deficient knee and the prevalence of meniscus and cartilage lesions: a systematic review and meta-analysis (CRD42017076897). Archives of Orthopaedic and Trauma Surgery 139, 819–841 (2019).
6. Hagmeijer, M. et al. Secondary Meniscal Tears in Patients With Anterior Cruciate Ligament Injury: Relationship Among Operative Management, Osteoarthritis, and Arthroplasty at 18-Year Mean Follow-up.
7. Kaplan, Y. Identifying Individuals With an Anterior Cruciate Ligament-Deficient Knee as Copers and Noncopers: A Narrative Literature Review. Journal of Orthopaedic & Sports Physical Therapy 41, 758–766 (2011).
8. Eastlack, M. E., Axe M.J. & Snyder-Mackler, L. Laxity, instability, and functional outcome after ACL injury: copers versus noncopers. Medicine & Science in Sports & Exercise 31, 210–215 (1999).
9. Fitzgerald, G. K., Axe, M. J. & Snyder-Mackler, L. A decision-making scheme for returning patients to high-level activity with nonoperative treatment after anterior cruciate ligament rupture. Knee Surgery, Sports Traumatology, Arthroscopy 8, 76–82 (2000).
10. Aga, C. et al. Risk of Revision Was Not Reduced by a Double-bundle ACL Reconstruction Technique: Results From the Scandinavian Registers. Clinical Orthopaedics and Related Research 475, 2503–2512 (2017).
11. Schlumberger, M. et al. Traumatic graft rupture after primary and revision anterior cruciate ligament reconstruction: retrospective analysis of incidence and risk factors in 2915 cases. Knee Surgery, Sports Traumatology, Arthroscopy 25, 1535–1541 (2017).
12. Magnussen, R. A., Meschbach, N. T., Kaeding, C. C., Wright, R. W. & Spindler, K. P. ACL Graft and Contralateral ACL Tear Risk within Ten Years Following Reconstruction. JBJS Reviews 3, 1 (2015).
13. Webster, K. E., McPherson, A. L., Hewett, T. E. & Feller, J. A. Factors Associated With a Return to Preinjury Level of Sport Performance After Anterior Cruciate Ligament Reconstruction Surgery. The American Journal of Sports Medicine 47, 2557–2562 (2019).
14. Filbay, S. R. & Grindem, H. Evidence-based recommendations for the management of anterior cruciate ligament (ACL) rupture. Best Practice & Research Clinical Rheumatology 33, 33–47 (2019).
15. Lie, M. M., Risberg, M. A., Storheim, K., Engebretsen, L. & Øiestad, B. E. What’s the rate of knee osteoarthritis 10 years after anterior cruciate ligament injury? An updated systematic review. British Journal of Sports Medicine (2019). doi:10.1136/bjsports-2018-099751
16. Øiestad, B. E., Holm, I. & Risberg, M. A. Return to pivoting sport after ACL reconstruction: association with osteoarthritis and knee function at the 15-year follow-up. British Journal of Sports Medicine 52, 1199–1204 (2018).
17. Hay, M. C. et al. Harnessing experience: exploring the gap between evidence-based medicine and clinical practice. Journal of Evaluation in Clinical Practice 14, 707–713 (2008).
18. Vittersø, A. D., Keogh, E. & Gauntlett-Gilbert, J. Reasons for Treatment Non-Response: A Controlled Study of Patients’ Views in Pain Rehabilitation. Behavioural and Cognitive Psychotherapy 46, 238–243 (2018).
19. Vlaeyen, J. W. S. & Linton, S. J. Fear-avoidance and its consequences in chronic musculoskeletal pain: a state of the art. Pain 85, 317–332 (2000).
20. George, S. L. Research misconduct and data fraud in clinical trials: prevalence and causal factors. International Journal of Clinical Oncology 21, 15–21 (2016).
21. Deshmukh, M., Dodamani, A., Khairnar, M. & Naik, R. Research misconduct: A neglected plague. Indian Journal of Public Health 61, 33 (2017).
22. Mlinarić, A., Horvat, M. & Šupak Smolčić, V. Dealing with the positive publication bias: Why you should really publish your negative results. Biochemia Medica 27, (2017).
Fotnoter
[1] https://www.scientificamerican.com/article/a-medical-madoff-anesthestesiologist-faked-data/
[2] Figur oversatt og modifisert av forfatter basert på originalfigur hentet fra https://statistically-funny.blogspot.com/search?updated-max=2012-12-08T16:07:00-05:00&max-results=10&start=20&by-date=false






















