
En pilotstudie: Endring i smertetoleranse som følge av høyintensiv aerob aktivitet
Vitenskapelig artikkel i Fysioterapeuten 5/2015.
Julie Rennan, turnusfysioterapeut, Helse Nord-Trøndelag, Sykehuset Levanger. Julie_rennan@hotmail.com.
Mari Nilsen Skinnes, turnusfysioterapeut Ørsta kommune. mskinnes@hotmail.com.
Berit Østerås, MSc. fysioterapeut, høgskolelektor. Høgskolen i Sør-Trøndelag, avdeling for helse- og sosialfag, program for fysioterapeututdanning.
Denne vitenskapelige artikkelen er fagfellevurdert etter Fysioterapeutens retningslinjer, akseptert 18.2.2015. Ingen interessekonflikter oppgitt.
Merknad: Delt 1. forfatterskap mellom Julie Rennan og Mari Nilsen Skinnes.
Sammendrag
Hensikt: Å undersøke eventuelle endringer i PainMatcher-verdier hos friske, som mål på toleranse for nociseptive stimuli før, under og etter høyintensiv aerob aktivitet.
Design: Single Subject Design (SSD).
Materiale: Tolv kvinnelige friske fysioterapistudenter. Ti deltakere fullførte studien.
Metode: Tretti minutters høyintensiv løping kontrollert for intensitet (fastsatt på bakgrunn av forhåndstesting) og tid. PainMatcher-verdier ble registrert før, hvert tiende minutt underveis i intervensjonen, samt 15 minutter etter endt intervensjon. Analyse av de 50 PainMatcher-verdiene ble gjort med Huynh-Feldt-korrigert «General Linear Model» (GLM) for repeterte målinger samt Bonferroni-korrigert post hoc-analyse for parvise sammenligninger mellom måletidspunkt.
Resultat: Analyser viste signifikant endring av de 50 PainMatcher-verdiene i løpet av intervensjonen; «within-subjects effects» (F (3.989) =5.334, p<0.05) med måling 4 (etter 30 minutter) som signifikant forskjellig (p<0.05) fra alle de andre målingene, bortsett fra måling 3 (etter 20 minutter).
Konklusjon: De samlede PainMatcher-verdiene (n=50) viste en signifikant endring i løpet av intervensjonen med høyeste verdier etter 20 og 30 minutter. På individnivå oppnådde ni av ti deltakere en klar økning i PainMatcher-verdier som følge av intervensjonen. Sammenlignet med andre studier tyder dette på at PainMatcher er like følsom for toleranseendringer som andre måleinstrumenter for nociseptive stimuli.
Nøkkelord: treningsindusert hypoalgesi, PainMatcher, varighet, friske kvinner.
Innledning
Fysisk aktivitet og trening er mye benyttet innenfor fysioterapi, både klinisk og i vitenskapelige studier. Den antatte effekten av trening for å oppnå smertemodulering og/eller velvære har fått økt vitenskapelig oppmerksomhet og benyttes alene som indikasjon for anvendelse i klinikken (1, 2). Det er likevel flere sider ved treningsindusert smertemodulering som ikke er forstått og/eller dokumentert (3).
Hypoalgesi er en del av den sentrale smertemoduleringen, og refererer til minsket sensitivitet for smertefull stimulering (4). Hypoalgesi kan aktiveres både på spinalt og sentralt nivå ved trening, men det er uklart hvilke mekanismer som ligger bak denne effekten. Den mest diskuterte hypotesen er at opoider frigjøres under trening og dermed blokkerer for smertesignalet (5, 6). De fleste studier har konkludert med at toleransen for nociseptive stimuli øker spesielt ved aerob aktivitet med relativt høy intensitet (4). Det finnes i dag få studier som sier noe om hvordan varigheten av fysisk aktivitet påvirker toleransen for nociseptive stimuli, og de eksisterende studiene har noe motstridende resultater (4, 5, 7). Hvor lang tid det tar før en eventuell aktivitetsindusert opoidfrigjøring inntrer, og hvordan en mulig oppnådd hypoalgesi utvikler seg underveis i løpet av en treningsøkt, er fremdeles uklart.
Elektrisk stimulering er en av de vanligste formene for eksperimentell påføring av smerte på mennesker (4). PainMatcher (Cefar Medical AB, Lund, Sweden) er et instrument for selvapplisering som avgir lavfrekvente elektriske impulser. Instrumentet avgir strøm i økende styrke gjennom elektroder forsøkspersonen holder mellom tommel og pekefinger. Så fort den oppdager en åpen krets, altså at deltakeren slipper en eller begge fingre, opphører den konstant økende strømmen, og den registrerer et tall mellom 1 og 99. Denne verdien kan så avleses fra skjermen på instrumentet, og utgjør én av totalt tre målinger i en måleserie. Eventuelle endringer i toleransen under og etter fysisk aktivitet, kan tenkes å avspeile en aktivitetsindusert hypoalgesi.
Hvordan blir PainMatcher-verdier, som mål på toleranse for nocisepsjon, påvirket av høyintensiv aerob aktivitet hos friske?
Materiale og metode
Deltakere
Tolv friske kvinnelige fysioterapistudenter i alderen 21 til 27 år deltok i studien. Inklusjonskriteriene var at man måtte være kvinne, ha noe erfaring med å løpe på tredemølle fra før, ikke ha noen kroniske smertetilstander eller sykdommer, ikke ha noen annen form for smerte, ikke ha tatt smertestillende medikamenter samme dag som forsøket, ikke ha noen skader som forhindrer løping på tredemølle, og ikke ha hjerteproblemer. I tillegg skulle deltakerne unngå å trene 24 timer før testing, samt unngå mat, nikotin og koffein to timer før de skulle testes.
Spørreskjema
Det ble utformet et spørreskjema som baserte seg på spørsmål om deltakernes treningsvaner og motivasjon rundt løping på tredemølle. Dette ble brukt som et underordnet verktøy for å kartlegge hvor homogen deltakergruppen var. Skjemaet er ikke validert eller testet for reliabilitet.
PainMatcher
PainMatcher ble valgt ut som instrument for å måle hvordan smertetoleransen endrer seg fordi den er enkel å bruke, ikke-invasiv og lett å anvende i en klinisk setting. Flere studier har vurdert PainMatcher i forhold til anerkjente målemetoder som VAS-skalaen og Numeric Rating Scale (NRS). Testingen har hovedsaklig foregått på pasienter med smerter fra før, for å sammenligne den eksisterende smerten med nociseptiv stimuli påført av PainMatcher. Noen studier sier at PainMatcher er evaluert til å være valid og reliabel i forhold til VAS og NRS (8, 9). Andre har funnet at PainMatcher er reliabel, men at VAS er mer sensitiv for endringer i smerteintensitet (10). En studie fant liten korrelasjon mellom PainMatcher og VAS hos whiplash-pasienter (11).
Prosedyre
Deltakerne møtte opp to separate dager i treningsrommet til omtrent samme tid på dagen. Dag én og to ble gjennomført med minst 24 timers mellomrom.
Dag én skrev deltakerne under på samtykkeskjema, fylte ut spørreskjema om løpevaner og motivasjon, prøvde ut PainMatcher og gjennomførte en test for å finne maksimal hjertefrekvens, målt med pulsklokke. Dag to innebar høyintensiv løping kontrollert for intensitet og varighet, og registreringer gjort med PainMatcher. For å finne baseline-verdier fikk deltakerne prøve PainMatcherens tre måleserier á tre målinger før de gjennomførte intervensjonen. De ble bedt om å holde PainMatcheren til de syntes det var så ubehagelig at de måtte slippe. Deltakerne gjennomførte så en 30 minutters løpeøkt på tredemølle. De første ti minuttene var oppvarming, og foregikk derfor på en noe lavere intensitet enn resten av testen, som lå rett under anaerob terskel. Toleransen for lavfrekvente elektriske impulser ble testet hvert 10. minutt under intervensjonen og 15 minutter etter endt intervensjon. Deltakerne stoppet løpingen og stod med ett bein på hver side av møllen, slik at målingene kunne registreres. Registreringene tok 1-2 minutter. Deretter ble hastigheten justert, slik at de raskt kom opp på samme intensitet som før PainMatcher-målingen. Etter endt økt satt deltakerne i ro i 15 minutter før den siste målingen ble tatt. Deltakerne hadde ingen mulighet til å kontrollere hvor lenge de holdt i PainMatcheren underveis eller etterpå, da resultatene ble holdt skjult inntil de hadde fullført testingen. Resultatene er presentert som et gjennomsnitt av målingene gjort med PainMatcher ved hvert tidsintervall.
Dataanalyse IBM SPSS 21 ble brukt i analysene av datamaterialet. Kolmogorov-Smirnov test ble benyttet i undersøkelse av normalfordeling av PainMatcher-verdiene. Huynh-Feldt korrigert «General Linear Model» (GLM) for repeterte målinger ble brukt for å undersøke gjennomsnittlig endring av PainMatcher-verdiene (avhengig variabel) mellom måletidspunktene; 5. nivå, faktor 1. Parvise sammenligninger av gjennomsnittsverdiene ved de ulike målingene ble gjort ved hjelp av Bonferroni-korrigert post hoc-analyse.
Resultat
Spørreskjema
Av spørreskjemaet kom det fram at alle deltakerne løp ukentlig. Åtte av ti brukte løping på tredemølle som treningsform ukentlig. De resterende to brukte samme treningsform månedlig. På spørsmål om hvor godt de likte å løpe, svarte fire deltakere at de likte løping svært godt, seks deltakere svarte de likte det godt, mens to deltakere oppga at de likte det lite godt. En likte svært godt å løpe på tredemølle, sju likte det godt, og to likte det lite godt.
PainMatcher
Det var store individuelle forskjeller i toleransen for elektriske impulser ved baseline-målingene. Noen deltakere hadde høye baseline-verdier sammenlignet med andre, men fikk likevel en økning underveis i intervensjonen på samme måte som deltakerne som lå lavere ved baseline. Samtlige deltakere, bortsett fra én, hadde en økning i smertetoleransen i løpet av intervensjonen, men det var individuelle forskjeller i hvilket tidsintervall den største økningen skjedde. Fem av ti hadde høyest PainMatcher-verdi i det 30. minuttet. Ikke alle deltakerne hadde gradvis økende PainMatcher-verdier mellom hver måling; flere hadde både synkende og økende verdier underveis selv om kurven jevnt over økte. Femten minutter etter intervensjonen sank toleransen fra høyeste registrering hos alle, bortsett fra hos én deltaker (tabell 1).
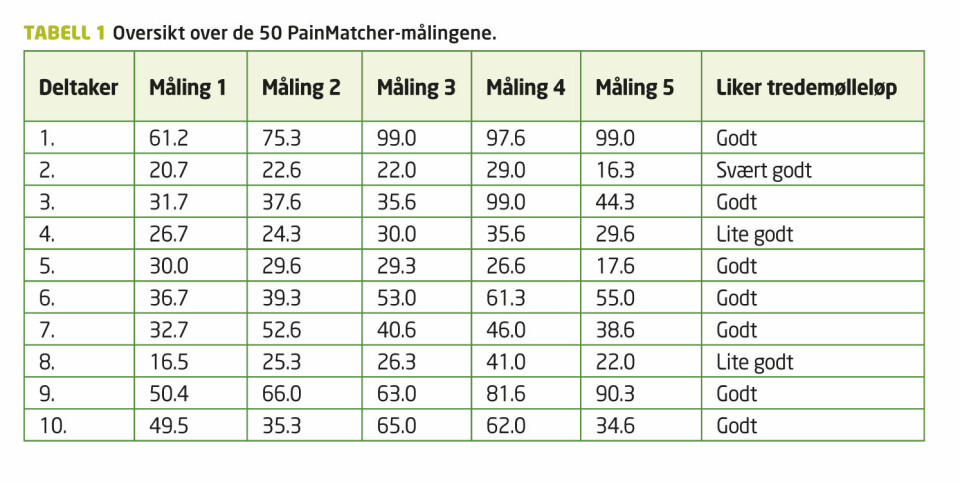
Kolmogorov-Smirnov test avdekket normalfordeling av de 50 PainMatcher-verdiene.
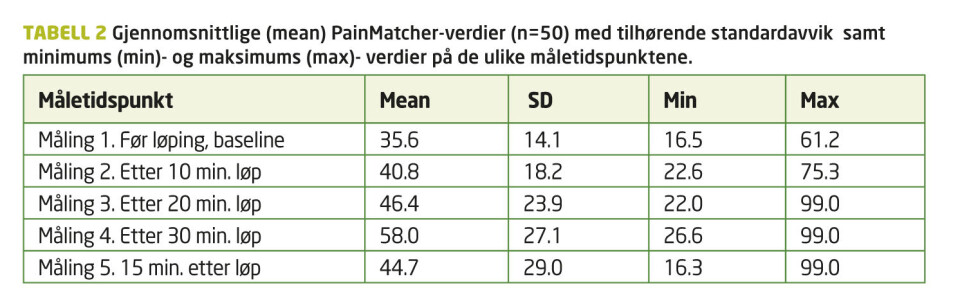
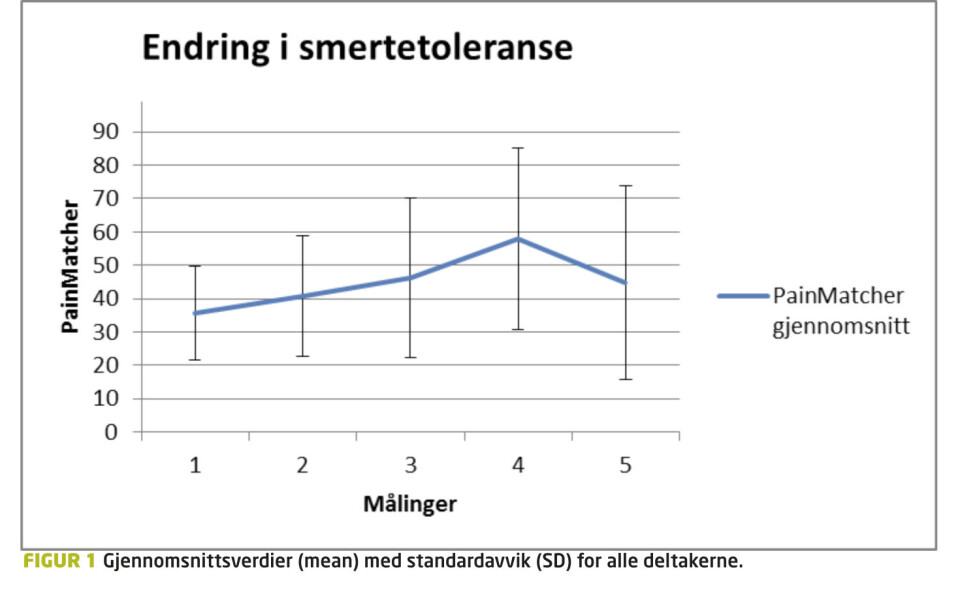
Huynh-Feldt korrigert GLM for repeterte målinger (5. nivå, faktor 1) viste signifikant gjennomsnittlig endring av PainMatcher-skåringene (avhengig variabel) i løpet av intervensjonen; «within-subjects effects» (F (3.989) =5.334, p<0.05). Gjennomsnittsverdier med standardavvik (SD) er gjengitt i Figur 1. Post hoc, Bonferroni-korrigerte parvise sammenligninger viste en signifikant gjennomsnittlig forskjell (p<0.05) mellom måling 4 og andre målinger bortsett fra måling 3.
Diskusjon
Resultater
Ut fra spørreskjema fremkom det at ingen av deltakerne mislikte å løpe. De fleste løp ukentlig. Dermed kan det diskuteres om resultatene kan tilskrives en placeboeffekt ved at deltakerne har positive erfaringer med løping, og en forventning om å føle seg bedre etter trening (12). På den andre siden var det to av studiens deltakere som likte løping på tredemølle lite godt. Det var ingen lavere score for disse sammenlignet med deltakerne som likte løping på tredemølle godt eller svært godt.
Ut fra figur 1 kan man se at resultatene preges av store individuelle forskjeller i toleranse for nociseptiv stimuli. De store standardavvikene kan skyldes individuell smertetoleranse hos deltakerne. Enhver smerteopplevelse er unik (13,14), og de fleste vil reagere ulikt på samme type elektrisk stimuli. Andre kognitive og emosjonelle faktorer kan også hatt innvirkning på resultatene. Smerteopplevelsen avhenger av situasjonen, menneskets sinnstilstand samt tidligere erfaringer og forventninger. Samlet avgjør dette hvordan hjernen tolker kroppens tilstand og hva som oppleves smertefullt eller ikke (15).
Intensitet og varighet
Varigheten i forsøket ble forstyrret ved at deltakerne stoppet opptil to minutter for å utføre registreringene med PainMatcher. Dermed ble det ikke en kontinuerlig økt på 30 minutter. Samtidig kom deltakerne raskt tilbake til ønsket intensitet da de begynte å løpe igjen. Flere studier har funnet at økt smertetoleranse som følge av trening er høyest rett etter intervensjonen, og synker gradvis mot baseline etter 30 til 50 minutter (5, 16). Dette indikerer at toleransen for nociseptive stimuli mest sannsynlig ikke blir påvirket i løpet av en til to minutter.
Blant deltakerne i studien var det relativt stort spenn mellom hvor stor prosentandel av maksimal hjertefrekvens de presterte i løpet av 30 minutter. Det optimale hadde vært om deltakerne lå på samme intensitet under intervensjonen, slik at utgangspunktet for treningsindusert hypoalgesi var mer likt for alle. Dette ville likevel ikke vært mulig med samme utvalg deltakere da kvinnene med lav anaerob terskel ville gått over til anaerob trening om de skulle løpt på en høyere intensitet.
Det observeres ikke en like stor økning i smertetoleranse de første ti minuttene som ved de andre målingene, da dette var en oppvarmingsfase. Den registrerte økningen er forenelig med Janal (17) og Gurevich et al. (18) som konkluderer med at submaksimal intensitet kan være nok til å skape økt toleranse for nociseptive stimuli.
Donevan og Andrew (19) fant en signifikant økning i sirkulerende beta-endorfin-nivåer, som fører til blokkering av smertesignalet, på intensiteter mellom 75 og 80 prosent av VO2max eller over. Denne studien tok utgangspunkt i dette, og fant at høyintensiv trening i 20 minutter gir en større gjennomsnittlig økning i smertetoleransen enn ved kortere varigheter.
PainMatcher
Det finnes flere studier som har sett på smertetoleransen etter trening. Funnene i denne studien viser at toleransen for smerte synker hos de fleste deltakerne 15 minutter etter endt intervensjon (5. måling), noe som også er forenelig med andre studier (3, 5, 16). Sammen med Hoffmann et al. (5), Olausson et al. (16), Janal et al. (17) og Gurevich et al. (18), er disse med på å underbygge at PainMatcher er like følsom for toleranseendringer, også hos friske personer, som andre måleinstrumenter for nociseptiv stimuli, anvendt i andre studier. Det er likevel en metodisk svakhet at studien ikke inkluderer to ulike måleinstrumenter slik at svarene fra de ulike instrumentene kan sammenlignes i hvert enkelt tilfelle.
Deltakerne testet PainMatcheren i forkant av forsøket for at registreringene i mindre grad skulle skyldes frykt eller tilvenning til stimuliet, og det er større sannsynlighet for at det er den reelle treningsinsduserte hypoalgesien som ble fanget opp av PainMatcher under intervensjonen. Til tross for dette kan det ikke utelukkes en ytterligere tilvenning eller læring underveis, da deltakerne ble utsatt for samme stimuli mange ganger.
Overføringsverdi til pasienter
Hvorvidt disse funnene har overføringsverdi til pasienter med smerter er enda ikke undersøkt. De fleste smertepasienter vil ikke kunne holde en så høy intensitet som er anvendt i denne studien. Det er tidligere gjort funn som viser at trening med lavere intensitet også påvirker smertetoleransen (18). Videre studier vil kunne avdekke om det vil være mulig å oppnå samme smertemodulerende effekt ved å kompensere for en lav intensitet med lengre varighet. Noen pasientgrupper med langvarige smerter kan antas å ha et ikke-adekvat smertesystem med redusert korrelasjon mellom nociseptoraktivering og smerteopplevelse (15). Dette vil sannsynligvis påvirke hvilken aktivitetsindusert analgetisk effekt som er mulig å oppnå. Det kan være av vitenskapelig og klinisk interesse å undersøke om PainMatcher også kan avdekke toleranseendring/smertemodulering hos pasienter med smerter, og studere hvilken intensitet og varighet som kreves i intervensjon for å oppnå denne effekten. I den forbindelse vil det være vesentlig å inkludere instrumenter som måler ulike aspekter ved den primære smerteopplevelsen hos pasienten, slik som opplevd intensitet og relevante psykologiske faktorer.
Konklusjon
De samlede PainMatcher-verdiene (n=50) viste en signifikant endring i løpet av intervensjonen med høyeste verdier etter 20 og 30 minutter. På individnivå oppnådde ni av ti deltakere en klar økning i PainMatcher-verdier som følge av intervensjonen, noe som antyder en toleranseøkning for nociseptive stimuli og en oppnådd aktivitetsindusert hypoalgesi blant deltakerne. Hos de fleste var toleranseøkningen gått tilbake 15 minutter etter avsluttet intervensjon.
Sammenligninget med andre studier tyder dette på at PainMatcher er like følsom for toleranseendringer som andre måleinstrumenter for nociseptive stimuli. Det er behov for forsøk med flere deltakere og flere måleinstrumenter for å utfordre og eventuelt underbygge funnene fra denne studien. Om funnene er overførbare til pasienter med smerter må undersøkes i egne kliniske studier.
Referanser
1. Meng, X.G., Yue, S.W. (2014). Efficacy of Aerobic Exercise for Treatment of Chronic Low Back Pain: A Meta-Analysis. American Journal of Physical Medicine and Rehabilitation. [Epub ahead of print]
2. Østerås B, Østerås H, Torstensen TA. (2013). Long-term effects of medical exercise therapy in patients with patellofemoral pain syndrome: results from a single-blinded randomized controlled trial with 12 months follow-up. Physiotherapy, 99(4), 311-6. doi: 10.1016/j.physio.2013.04.001. Epub 2013 Jun 10.
3. Jones, M.D., Booth, J., Taylor, J.L., Barry, B.K. (2014). Aerobic training increases pain tolerance in healthy individuals. Medicine and Science in Sports and Exercise, 46(8), 1640-1647. doi: 10.1249/MSS.0000000000000273.
4. Koltyn, K. F. (2002). Exercise-Indiced Hypoalgesia and Intensity of Exercise. Sports Medicine, 32(8), 477-487.
5. Hoffman M. D., Shepanski M. A., Ruble S. B., Valic Z., Buckwalter J. B., & Clifford P. S. (2004). Intensity and duration threshold for aerobic exercise–induced analgesia to pressure pain. Archives of Physical Medicine and Rehabilitation, 85(7), 1183-1187.
6. Boecker H., Sprenger T., Spilker M. E., Henriksen G., Koppenhoefer M., Wagner K. J., ... Tolle T. R. (2008). The Runner ’s High: Opioidergic Mechanisms in the Human Brain. Cerebral Cortex, 18(11), 2523-2531.
7. Janal, M.N. (1996). Pain sensivity, exercise and stoicism. Journal of the royal society of medicine, 89(7), 376-381.
8. Lundeberg, T., Lund, I., Dahlin, L., Borg E., Gustafsson, C., Sandin L., ... Eriksson, S. V. (2001). Reliability and Responsivness of Three Different Pain Assessments. Journal of Rehabilitation Medicine, 33(6), 279–283.
9. Käll, L.B., Kowalski, J. & Stener-Victorin, E. (2008). Journal of Rehabilitation Medicine, 40(3), 171–177.
10. Bergh, I. H., Stener-Victorin, E., Wallin, G., Mårtensson, L. (2009). Comparison of the PainMatcher and the Visual Analouge Scale for assesment of labour pain following administered pain relief treatment. Midwifery 27(1), 134-9.
11. Persson, A.L., Westermark, S., Merrick, D. Sjölund, B.H. (2009). Validity if electrical stimulus magnitude matching in chronic pain. Journal of Rehabilitation Medicine 41(11), 898–903.
12. Morgan, W. P. (1985). Affective beneficence of vigorios physical activity. Medicine and Science in Sports and Exercise 17(1), 94-100.
13. Ossipov, M. H., Dussor, G. O., Porreca, F. (2010). Central modulation of pain. The Journal of Clinical Investigation, 120(11), 3779–3787.
14. Butler, D. S., & Moseley, G. L. (2003). Explain Pain. Adelaide: Noigroup Publications.
15. Brodal, P. (2007). Sentralnervesystemet (4. utgave). Oslo: Universitetsforlaget.
16. Olausson, B., Eriksson, E., Ellenmarker, L., Rydenhaug, B., Shyu B. C., & Andersson S. A. (1986). Effects of naloxone on dental pain threshold following muscle exercise and low frequency transcutaneous nerve stimulation: a comparative study in man. Acta Physiologica Scandinavica, 126(2), 299-305.
17. Janal, M. N., Colt E. W. D., Clark W. C., & Glusman, M. (1984). Pain Sensitivity, Mood and Plasma Endocrine Levels in Man Following Long-Distance Running: Effects of Naloxone. Pain. 19(1), 13-25.
18. Gurevich, M., Kohn, P. M., & Davis, C. (1994). Exercise-induced analgesia and the role of reactivity in pain sensitivity. Journal of Sports Sciences, 12(6), 549-559.
19. Donevan, R. H., & Andrew, G. M. (1987). Plasma beta-endorphin immunoreactivity during graded cycle ergometry. Medicine and Scinece in Sports and Exercise, 19(3) 229-233.Grossman, A. & Sutton, J.R. (1985). Endorphins: What are they? How are they measured? What is their role in exercise? Medicine and Science in Sports and Exercise, 17(1), 74-81.

























